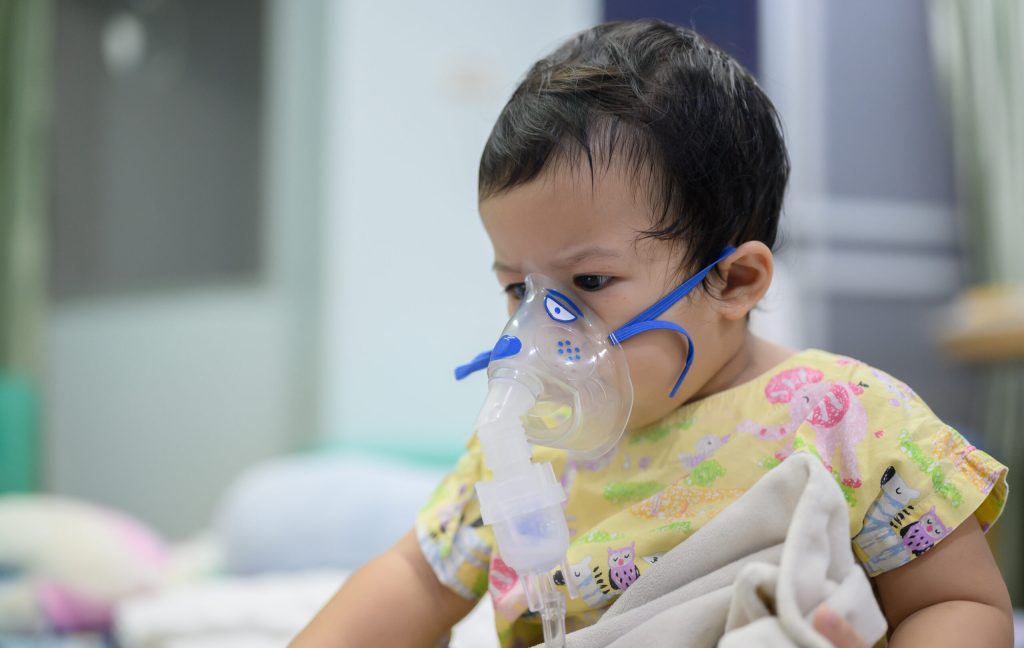
Está em vigor, até 9 de dezembro, a consulta pública para conhecer a opinião da sociedade sobre a incorporação ao Sistema Único de Saúde (SUS) da vacina Abrysvo, desenvolvida pela Pfizer e aprovada em abril deste ano no Brasil para a prevenção de doença respiratória provocada pelo vírus sincicial respiratório (VSR), principal causa de infecções respiratórias graves em crianças pequenas.
Neste momento, por meio da Comissão Nacional de Incorporação de Tecnologias no SUS (Conitec), o Ministério da Saúde avalia a possibilidade de incluir Abrysvo no Calendário Nacional de Vacinação da Gestante, pelo Programa Nacional de Imunizações (PNI), com aplicação de dose única entre as semanas 32 e 36 da gestação, de modo que os bebês já nasçam com resposta imune ao VSR. A vacina também está disponível nos centros e clínicas de vacinação particulares do País, para mulheres que se enquadrem na indicação aprovada no Brasil (24 a 36 semanas de gestação) e idosos.
Neste ano, considerando informações disponíveis até 7 de novembro, dados das autoridades de saúde apontam que o VSR se mantém como a causa mais frequente de síndrome respiratória aguda grave (SRAG) no Brasil, detectado em 36% dos diagnósticos com resultado positivo para algum vírus respiratório.
A forte presença do VSR no cenário epidemiológico brasileiro reforça os dados da literatura médica sobre o tema. Nos menores de 2 anos de idade, o VSR é responsável por até 40% das pneumonias e 75% dos quadros de bronquiolite – uma inflamação aguda das ramificações que conduzem o ar para dentro dos pulmões, podendo causar quadros graves, que demandam internação.
Globalmente, infecções por VSR também constituem uma das principais causas de morte em bebês. Altamente contagioso, o VSR está associado a surtos em ambientes hospitalares, sobretudo em unidades neonatais, com elevada morbimortalidade6. Estima-se que o VSR seja responsável por 66 mil a 199 mil mortes por ano em menores de 5 anos no mundo¹.
“Nesse cenário difícil, a chegada de Abrysvo representa um grande marco, tanto para o Brasil como para o mundo, reforçando o compromisso da Pfizer de inovar para oferecer soluções eficazes e seguras que respondam aos grandes desafios de saúde do nosso tempo”, diz a diretora médica da Pfizer Brasil, Adriana Ribeiro.
Segurança e eficácia
A aprovação regulatória de Abrysvo no Brasil foi baseada em resultados que demonstraram a eficácia e a segurança da vacina durante os estudos realizados em seu programa de desenvolvimento clínico.
No estudo de fase 3 para a indicação materno-fetal, a vacina se mostrou capaz de prevenir 82% das formas graves de doenças respiratórias causadas pelo VSR em crianças de até 3 meses de idade, porcentagem que se mantém elevada, em 69%, para bebês até os 6 meses.
Mais de 7 mil gestantes participaram do estudo, envolvendo 18 centros de pesquisa, sendo quatro deles localizados no Brasil: dois no Rio Grande do Sul, um em Santa Catarina e um no interior de São Paulo.
“Quando a mãe recebe a vacina, os anticorpos produzidos por ela atravessam a placenta, fortalecendo o organismo do bebê, cujo sistema imunológico ainda está em desenvolvimento”, explica a diretora médica da Pfizer.
“O desenvolvimento de vacinas para gestantes é considerado prioritário pela Organização Mundial de Saúde, podendo reduzir as taxas de mortalidade infantil, aliviar a sobrecarga hospitalar e evitar o forte impacto das doenças para as famílias”, complementa Adriana.
Acesso
Na América Latina, tanto Argentina quanto Uruguai já dispõem de Abrysvo em suas redes públicas de saúde. Neste mês, a Pfizer anunciou a assinatura de um acordo internacional com a Organização Pan-Americana da Saúde (OPAS) para que a vacina seja oferecida a Estados membros da entidade por meio de seu Fundo Rotativo para Acesso a Vacinas.
“Estamos orgulhosos de ver um assunto tão importante, como o enfrentamento do VSR, ocupar o centro das discussões de saúde pública no Brasil. Continuaremos a fazer todos os esforços para que Abrysvo possa chegar ao maior número possível de pessoas elegíveis em nosso País, para que possamos aumentar a proteção contra esse vírus tão desafiador”, diz a diretora de Primary Care da Pfizer Brasil, Camila Alves.
Abrysvo é a única vacina aprovada no Brasil com indicação para os dois grupos populacionais mais vulneráveis às infecções provocadas pelo vírus sincicial respiratório (VSR): bebês (a partir da imunização de suas mães, durante a gestação) e idosos.
A vacina também está licenciada nos Estados Unidos e na Europa, tanto para gestantes quanto para idosos, bem como em outros países e regiões.
Consulta pública e participação popular
A consulta pública é um mecanismo de participação social, de caráter consultivo, que busca promover o diálogo entre a administração pública e os cidadãos. É realizada com prazo definido e, no âmbito da saúde, oferece a qualquer pessoa a oportunidade de opinar sobre as decisões relacionadas ao setor, podendo ampliar a voz da população nos processos de incorporação e oferta de medicamentos e vacinas pelo SUS, por exemplo.
Para participar de uma consulta pública sobre a incorporação de novas tecnologias ao SUS, é preciso preencher um formulário na página da Conitec dentro do site do Ministério da Saúde. No caso de Abrysvo, a consulta pública é a de número 95/2024, disponível por meio do seguinte link: Governo Federal – Participa + Brasil – Consulta Pública Conitec/SECTICS nº 95/2024 – Vacina VSR A e B (recombinante) para a prevenção de DTRI e de DTRI grave causada por VSR em bebês por imunização ativa em gestantes
*Com informações da assessoria